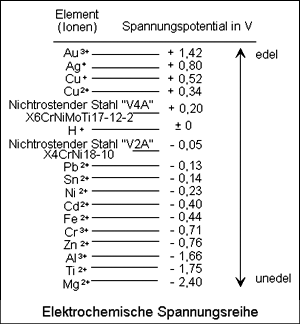
Elektrochemische Spannungsreihe
Die Standardpotenziale stellen ein Maß für das Reaktionsverhalten eines Redoxpaares in wässrigen Lösungen dar.
Die Redoxpaare werden daher nach der Größe ihrer Standardpotenziale geordnet, und man erhält eine Redoxreihe, die als elektrochemische Spannungsreihe bezeichnet wird.
Mit Hilfe der Spannungsreihe kann auf die reduzierende oder oxidierende Wirkung eines Redoxpaares geschlossen werden.
Je negativer das Standardelektrodenpotenzial ist, um so stärker wirkt ein Redoxpaar reduzierend (Reduktionsmittel) und desto leichter wird es selbst oxidiert. Die Redoxpaare von Oxidationsmitteln haben dagegen stärker positive Standardelektrodenpotenziale.
Metalle mit einem negativen Standardelektrodenpotenzial werden als unedle Metalle bezeichnet. Metalle mit positivem Potenzial, die in der Spannungsreihe unterhalb von Wasserstoff stehen, lösen sich nicht in Säuren unter H2-Entwicklung. Man bezeichnet sie daher als edle Metalle.
Bei einer Reihe von Metallen wird keine Auflösung in Wasser und Säuren festgestellt, anders als dies nach der Spannungsreihe zu erwarten wäre.
Durch die Bildung einer festen, schwer löslichen Oxidschicht erscheinen die Metalle edler (Passivität). Bsp. Al, Cr, Ni, Zn

Tabelle 1: Elektrochemische Spannungsreihe (Auszug)
Für die praktische Bewertung des Korrosionsverhaltens von Metallen werden Spannungsreihen erstellt, die die Potenziale der unterschiedlichen Metalle in Modellelektrolyten wiedergeben.
Fehlende Tabelle
Tabelle 2: Praktische Spannungsreihen